F. Javier Cabañes
Grupo de Micología Veterinaria, Departamento de Sanidad y Anatomía Animales, Facultad de Veterinaria, Universitat Autònoma de Barcelona, Bellaterra, España.
Si bien últimamente, a raíz de la pandemia de COVID-19, estamos acostumbrados a escuchar en los medios de comunicación nuevas propuestas exitosas de vacunas víricas y disponemos desde hace mucho tiempo de un amplio abanico de vacunas contra diferentes enfermedades bacterianas, todavía no existe ninguna vacuna fúngica eficaz y autorizada para su uso en humanos.
Esto se debe en gran medida a la complejidad molecular y la naturaleza eucariota de los hongos patógenos como dianas inmunológicas, junto a su capacidad para evadir la inmunidad adquirida de forma natural y la inducida por las vacunas. No obstante, la resistencia a los antifúngicos está aumentando principalmente en algunas especies de Aspergillus y Candida, y una estrategia para evitar su falta de efectividad en el tratamiento de algunas micosis podría ser el desarrollo de vacunas fúngicas [Pattison et al. 2021]. En la actualidad, no hay vacunas en desarrollo contra las aspergilosis y existen pocos datos sobre la efectividad de vacunas ensayadas contra las candidiasis. Por lo que respecta a los animales domésticos, hasta la fecha sólo se ha autorizado con éxito una vacuna fúngica para reducir los signos clínicos y prevenir la tiña en el ganado bovino.
Esta vacunación fue introducida en la antigua Unión Soviética en la década de 1960 por el micólogo ruso Sarkisov. En este caso se utilizó una vacuna atenuada que contenía microconidios viables de la cepa LTF-130 de Trichophyton verrucosum. Esta cepa sigue siendo la misma que se utiliza en la vacuna comercial actual.
Quizás esta falta de vacunas para la prevención de las micosis pueda cambiar pronto con una prometedora vacuna contra la coccidioidomicosis. En este caso se trata de una micosis sistémica que afecta tanto a animales como a humanos y se contrae por inhalación de artroconidios de Coccidioides posadasii y Coccidioides immitis. Para desarrollar esta vacuna viva atenuada, previamente se obtuvo una cepa avirulenta mutante de C. posadasii por delección del gen CPS1 [Shubitz et al. 2021]. Esta enfermedad es típica de zonas áridas o semiáridas y endémica de las regiones del suroeste de Estados Unidos, México, Centroamérica y Sudamérica.
Más de la mitad de las infecciones humanas son asintomáticas y confieren resistencia a la enfermedad ante futuras exposiciones. Las demás dan lugar a una enfermedad clínica, que se calcula que afecta anualmente a aproximadamente el 1% de las personas en las zonas fuertemente endémicas de Arizona y el Valle Central de California. Los perros también son muy susceptibles a la coccidioidomicosis y su tasa de infección es mayor que la de los humanos. Las formas de la enfermedad son similares, pero las complicaciones se acercan al 25% de los casos en estos animales, que además suelen recibir tratamientos de larga duración con antifúngicos. El coste de estos tratamientos puede llegar a ser una carga excesiva para los propietarios y conllevar la eutanasia o al abandono de los animales.
Por lo tanto, la morbilidad y la mortalidad de esta enfermedad son significativas en perros y humanos, y una vacuna eficaz para prevenir la coccidioidomicosis sería beneficiosa para ambos. Esta vacuna candidata parece ser bien tolerada en los perros y los protege significativamente de la coccidioidomicosis inducida experimentalmente. El problema de salud pública per cápita de la coccidioidomicosis en las regiones endémicas de Estados Unidos es similar al de la poliomielitis, el sarampión, las paperas o la rubeola antes de que hubiera vacunas eficaces para estas enfermedades.

En el caso de los perros se produce también la infección asintomática, la enfermedad respiratoria primaria y la enfermedad diseminada. [Davidson et al. 2019]. No obstante, en este tipo de animales se observa una alta tasa de diseminación que puede llegar a producirse en casi todos los tejidos del cuerpo, siendo el óseo el más comúnmente afectado. Al igual que en los humanos, la coccidioidomicosis pulmonar es la forma más común en perros. Los animales afectados presentan tos, fiebre variable, anorexia y pérdida de peso. Los perros con coccidioidomicosis diseminada pueden presentar lesiones cutáneas, osteomielitis, enfermedad del SNC y o afectación pericárdica. Los signos clínicos de la enfermedad pulmonar o diseminada pueden estar presentes durante días o años antes de que los propietarios de los perros busquen atención veterinaria. Con respecto al tratamiento, el fluconazol es el fármaco principalmente utilizado para tratar todas las formas de coccidioidomicosis en estos animales, por ser más económico y presentar una biodisponibilidad oral muy alta y una toxicidad relativamente baja. Generalmente se seleccionan otros azoles o la anfotericina B cuando la enfermedad no responde a fluconazol, empeora o se disemina.
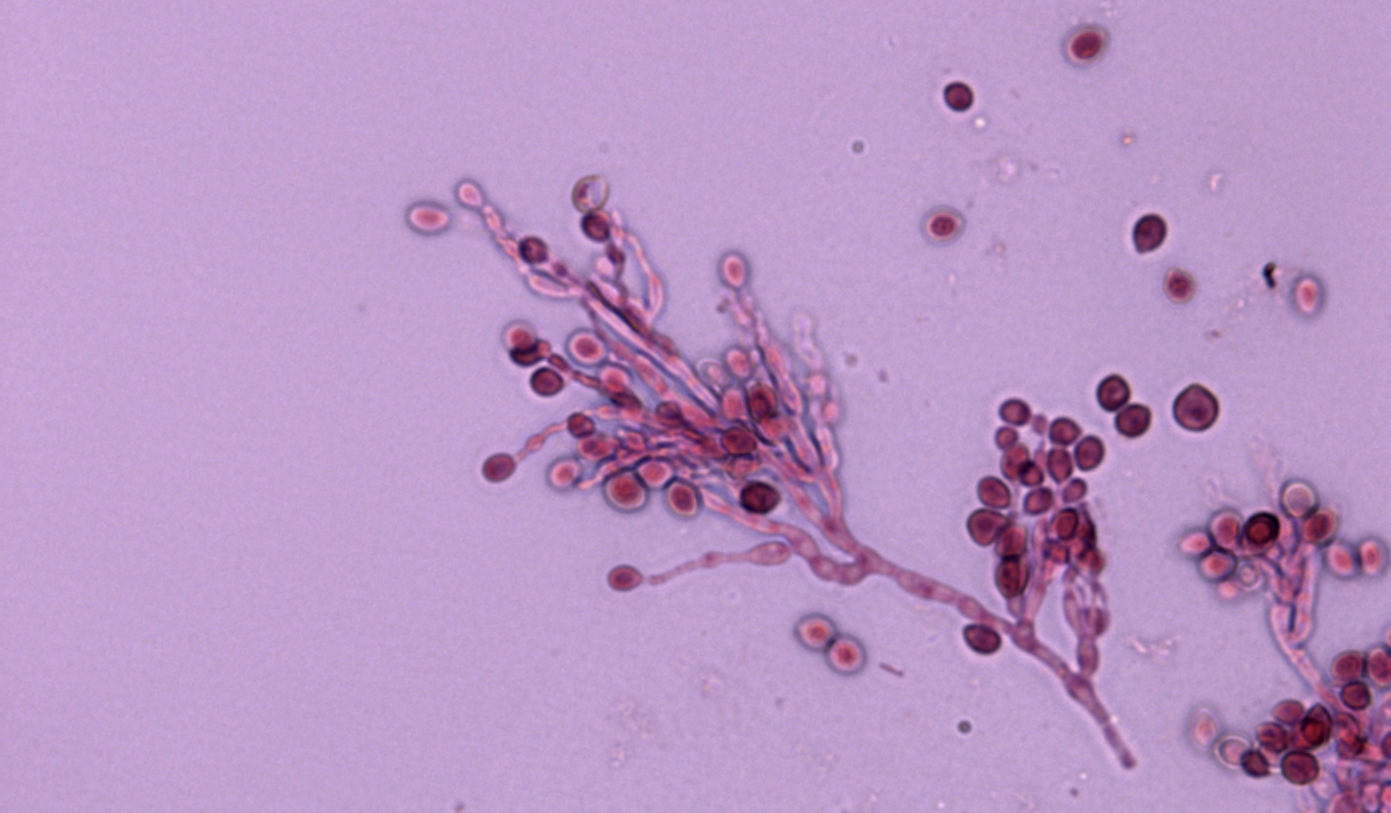
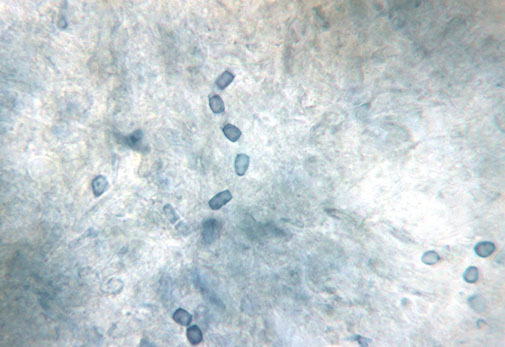
Los hongos causantes de estas micosis son dimórficos. Tras la inhalación de los artroconidios formados en la fase miceliar, éstos se convierten en esférulas repletas de endoconidios en los tejidos del hospedador, constituyendo la fase parasitaria. Muy importante desde el punto de vista epidemiológico de esta enfermedad: los pequeños mamíferos infectados que habitan en el desierto constituyen el reservorio de las especies de Coccidioides en las zonas endémicas.