F. Javier Cabañes
Grupo de Micología Veterinaria, Departamento de Sanidad y Anatomía Animales, Facultad de Veterinaria, Universitat Autònoma de Barcelona, Bellaterra, España.
La histoplasmosis es una micosis sistémica clásica causada por el patógeno primario Histoplasma capsulatum. Entre los animales de compañía se describe más frecuentemente en perros y gatos. Este hongo se distribuye por todo el mundo en países de climas templados y subtropicales y es principalmente endémico de los EEUU, con mayor prevalencia en los valles de los ríos Ohio, Missouri y Mississippi, de donde derivan la mayoría de los casos publicados que afectan a estos animales. En Europa esta micosis se considera rara y se han descrito muy pocos casos autóctonos o de importación en estos animales. En una búsqueda en Pubmed utilizando los siguientes descriptores: “Histoplasmosis” AND “dogs” AND “Europe” y “Histoplasmosis” AND “cats” AND “Europe”; (7 de septiembre 2021), se incluyen un total de 8 artículos contrastando con los 50 existentes utilizando el descriptor “USA”. En Europa, la mayoría de las publicaciones proceden de Italia y ninguna de España.

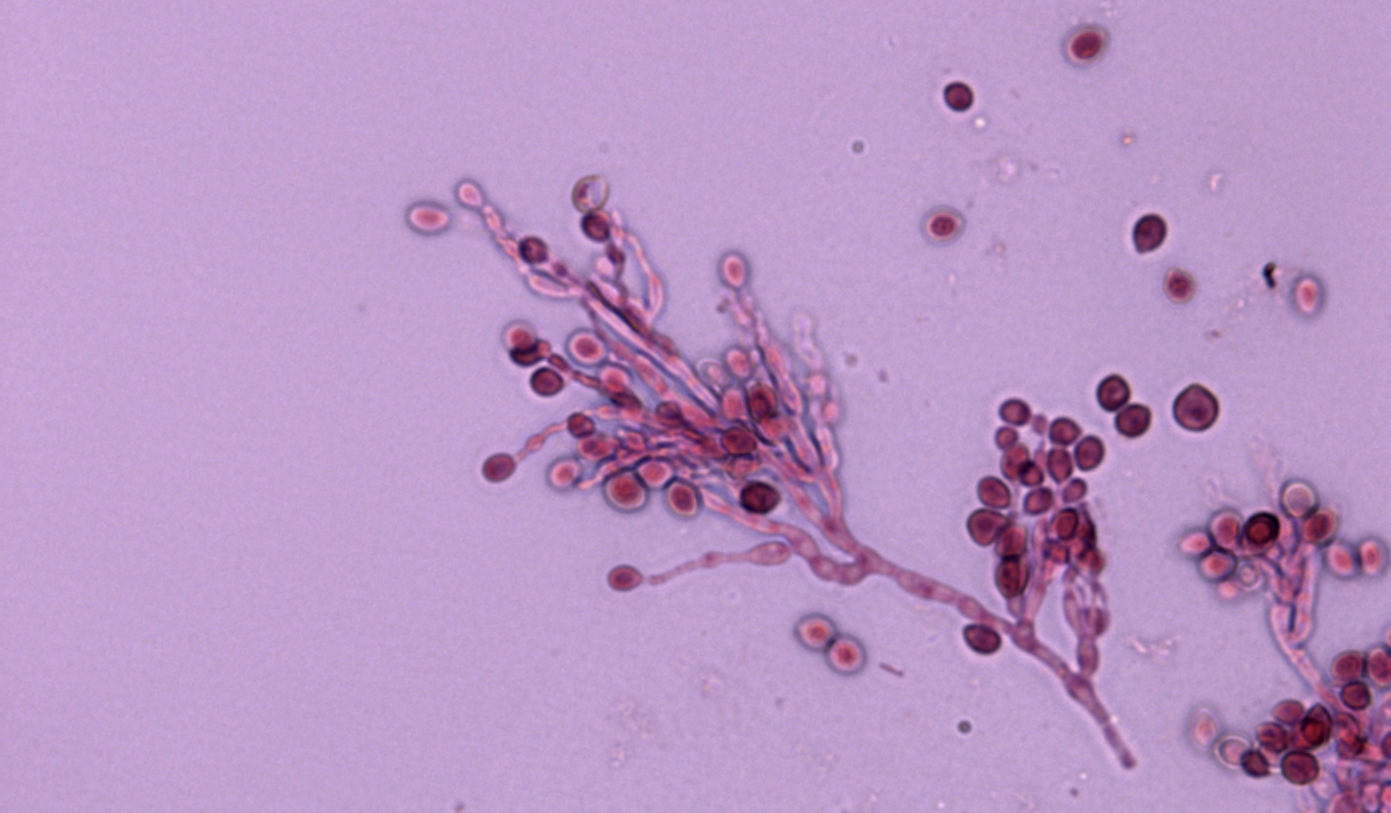
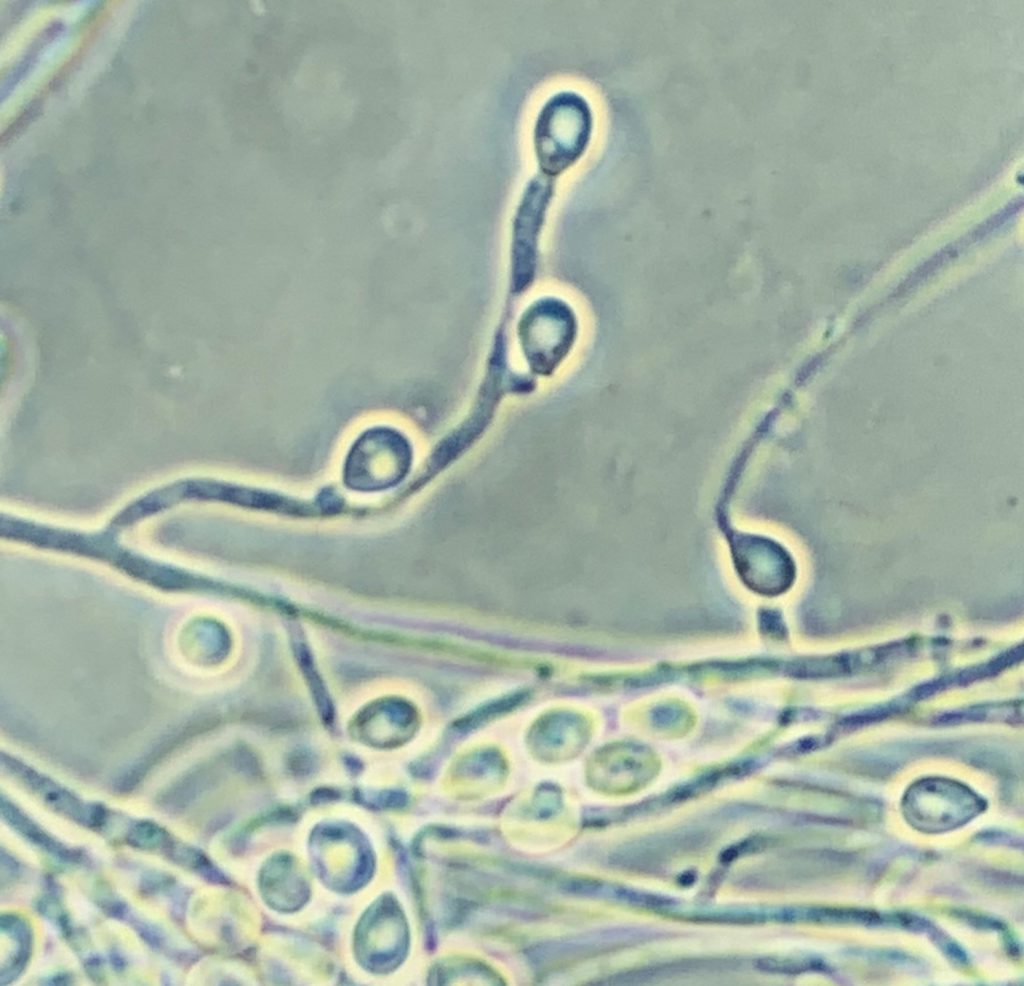
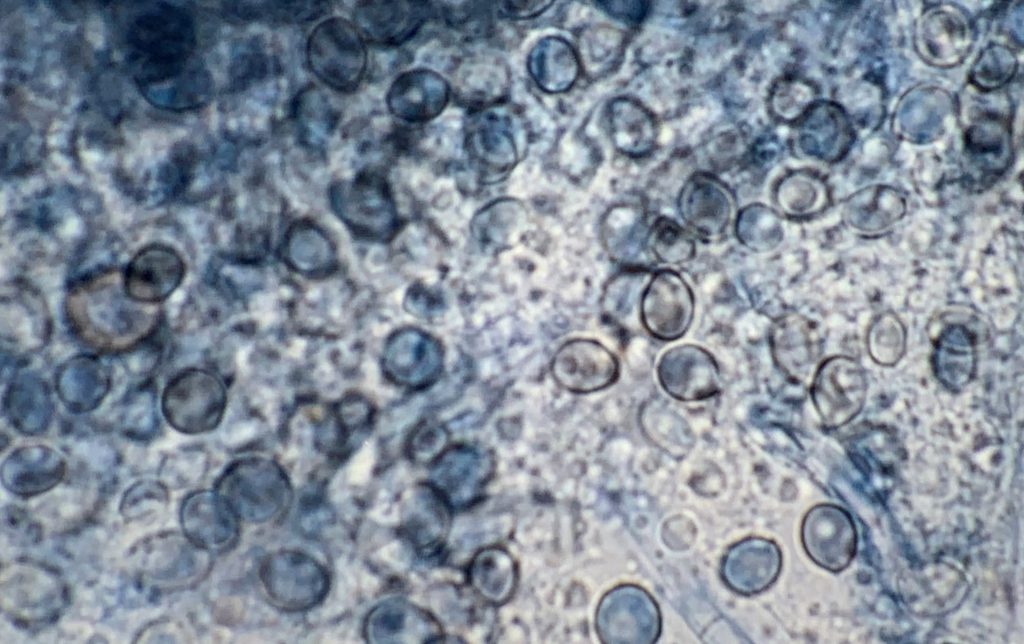
La infección se produce por la inhalación de conidios de la fase miceliar del hongo presente principalmente en suelos con materia orgánica rica en nitrógeno (p.e. excrementos de aves o murciélagos). Al ser un hongo dimórfico, estos conidios se convierten en levaduras en los tejidos del animal, que se pueden detectar mediante diferentes técnicas histológicas.
Aunque la mayoría de las infecciones suelen ser subclínicas, en perros y gatos la enfermedad suele causar inapetencia, pérdida de peso y fiebre. La histoplasmosis presenta diversas formas que van desde una enfermedad respiratoria leve hasta formas diseminadas que pueden afectar a cualquier órgano o tejido, como el bazo, el hígado, la médula ósea, los huesos y las articulaciones.
No obstante, recientemente se han publicado dos casos muy poco frecuentes de histoplasmosis con afectación de la cavidad nasal, con formas similares a algunas criptococosis y aspergilosis en perros y gatos. En el primer caso, un gato de dos años presentaba los signos clínicos clásicos de las formas sinonasales de estas micosis: secreción nasal crónica con deformidad facial y lesiones cutáneas afectando áreas perioculares [Grinstead et al. 2021]. Según la experiencia de los autores, el diagnóstico de la histoplasmosis en los gatos suele retrasarse. Esto podría deberse, en parte, a la sospecha clínica inicial de enfermedades inflamatorias más comunes como el cáncer o infecciones víricas y bacterianas. En este caso, al final se pudo confirmar el diagnóstico mediante histopatología y cultivo del hongo a partir del líquido de un lavado nasal. Después de recibir distintos tratamientos, al gato se le administró itraconazol. Después de más de un año de la visita inicial, el animal presentó la prueba negativa de detección de antígeno de Histoplasma en orina y junto con la ausencia de signos clínicos y la continua remodelación ósea de la cavidad nasal sugirieron que el gato seguía en remisión clínica. El pronóstico de la histoplasmosis en gatos es variable. Aproximadamente dos tercios de los animales tratados sobreviven seis meses después del diagnóstico.
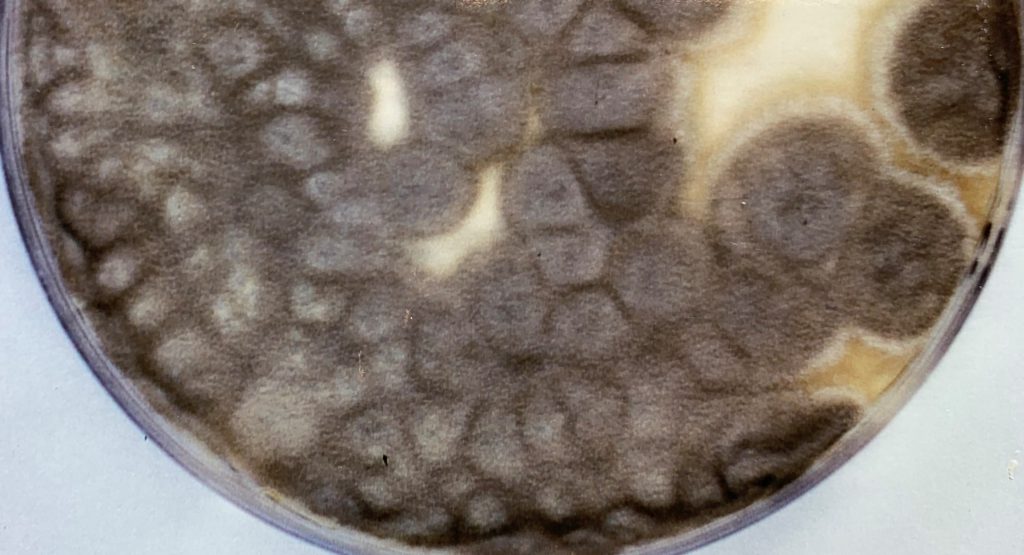
En el segundo caso, un perro de cuatro años y medio presentaba desde hacía tres meses estornudos, secreción nasal unilateral e inflamación de la fosa nasal izquierda [Heilmann et al. 2021]. La histoplasmosis se diagnosticó mediante examen histopatológico y con una prueba ELISA de detección de antígenos de Histoplasma. Esta última prueba no es concluyente por sí sola, ya que se ha citado reacción cruzada con otras micosis endémicas (p.e. blastomicosis, coccidioidomicosis). Sin embargo, puede ser útil para monitorizar la evolución de la infección. En esta ocasión el cultivo no se llevó a cabo. Para obtener la fase miceliar de este hongo a partir de las muestras se utilizan medios de cultivo rutinarios (p.e. Agar glucosado de Sabouraud con antibiótico) incubando a 25-30ºC. Debido al crecimiento lento del hongo, el resultado de esta prueba se puede llegar a retrasar varias semanas. No obstante, se considera la técnica de elección para confirmar el diagnóstico. También se puede realizar la técnica de reversión de la fase miceliar obtenida a la fase levaduriforme, cultivándola en medios enriquecidos (p.e. medio de agar infusión cerebro-corazón) e incubando a 37ºC. Actualmente se pueden utilizar técnicas de PCR que son mucho más rápidas de realizar, aunque no están estandarizadas ni se comercializan. En este caso, el tratamiento con itraconazol oral condujo a la normalización del aspecto de la trufa y de la fosa nasal del perro, con ausencia de signos de la enfermedad después de más de 6 años del último examen. El pronóstico es variable en perros con histoplasmosis. Las tasas de supervivencia de estos animales con enfermedad pulmonar, gastrointestinal o histoplasmosis diseminada oscilan del 33 al 78%; por lo general, los resultados son mejores para los pacientes con enfermedad localizada.
Clásicamente, en función de la clínica, la distribución geográfica y la morfología del hongo se reconocen tres variedades de esta especie: H. capsulatum var. capsulatum, que es un patógeno humano con amplia difusión en el continente americano y responsable de la histoplasmosis clásica, H. capsulatum var. duboisii, presente en África Central y Occidental y causante de la histoplasmosis africana y H. capsulatum var. farciminosum, presente en Europa, Asia y Norte de África y responsable de linfangitis epizoótica en los equinos. Sin embargo, desde hace algunos años se conoce que estas tres variedades son artificiales y que la especie incluye diferentes grupos genéticos. Recientemente, mediante estudios genómicos, cuatro de estos grupos genéticos, todos ellos endémicos del continente americano, se han propuesto como nuevas especies: H. capsulatum sensu stricto, H. mississippiense, H. ohiense y H. suramericanum [Sepúlveda et al. 2017]. Por otra parte, aunque sólo se estudiaron dos cepas del grupo correspondiente a la variedad africana, los autores remarcan que éstas presentaron suficientes diferencias genéticas para poder considerarse como una nueva especie.
Actualmente, desconocemos como afecta esta nueva propuesta de especiación a los aislamientos existentes de perros y gatos, ya que en este estudio no se incluyeron cepas procedentes de estos animales. No obstante, debido a que la mayoría de casos descritos de histoplasmosis se localizan en EEUU, no sería de extrañar que las especies crípticas H. mississippiense (grupo NAm1) y H. ohiense (grupo NAm2) fueran predominantes.