F. Javier Cabañes
Grupo de Micología Veterinaria, Departamento de Sanidad y Anatomía Animales, Facultad de Veterinaria, Universitat Autònoma de Barcelona, Bellaterra, España.
La blastomicosis es una infección fúngica sistémica que afecta sobre todo a los perros y en menor medida al hombre y otros mamíferos. Esta micosis es endémica en ciertas regiones de Estados Unidos y Canadá alrededor de los Grandes Lagos y en los valles de los ríos Ohio y Mississippi. Se estima que la tasa de incidencia de la enfermedad es ocho veces superior en los perros que en los humanos. Por tanto, los perros pueden servir de centinelas de la exposición humana. Durante muchos años, el único agente descrito causante de esta enfermedad ha sido Blastomyces dermatitidis. Recientemente, con el fin de identificar los factores de riesgo de infección por B. dermatitidis en perros y humanos, se ha investigado la prevalencia y distribución de los casos de blastomicosis canina en Michigan [Shelnut et al. 2020]. Michigan presenta una de las mayores densidades de lagos, estanques, ríos y arroyos en los EEUU. Al contrario de lo que se había indicado anteriormente, la mayoría de las infecciones por blastomicosis se adquirieron en la Península Superior o en las regiones más septentrionales de la Península Inferior de este estado. Viajar o residir al norte del paralelo 45 fue el factor de predicción más importante para la aparición de la blastomicosis.
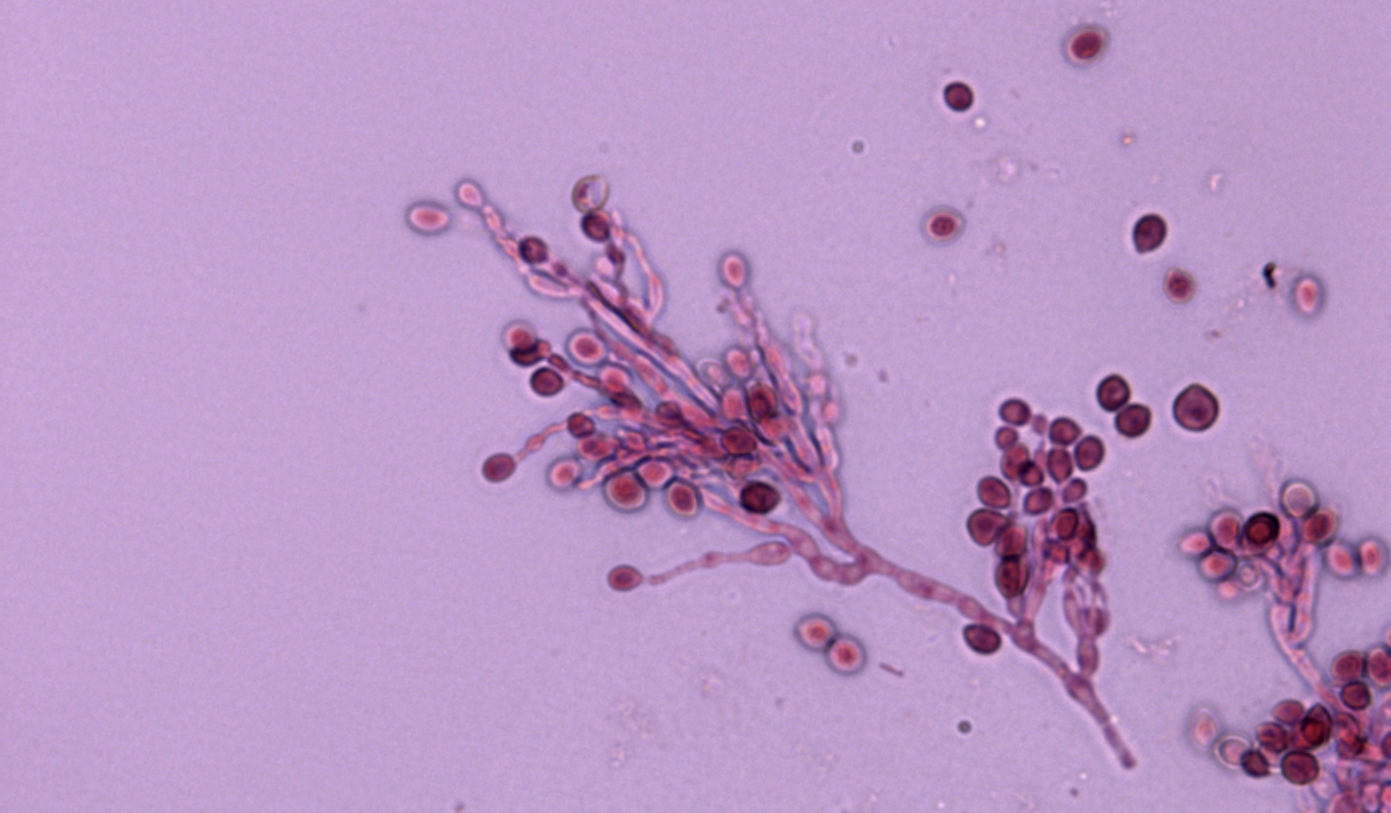
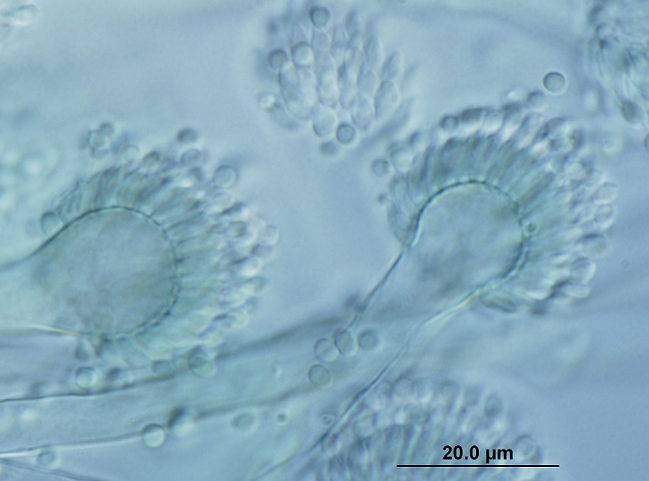
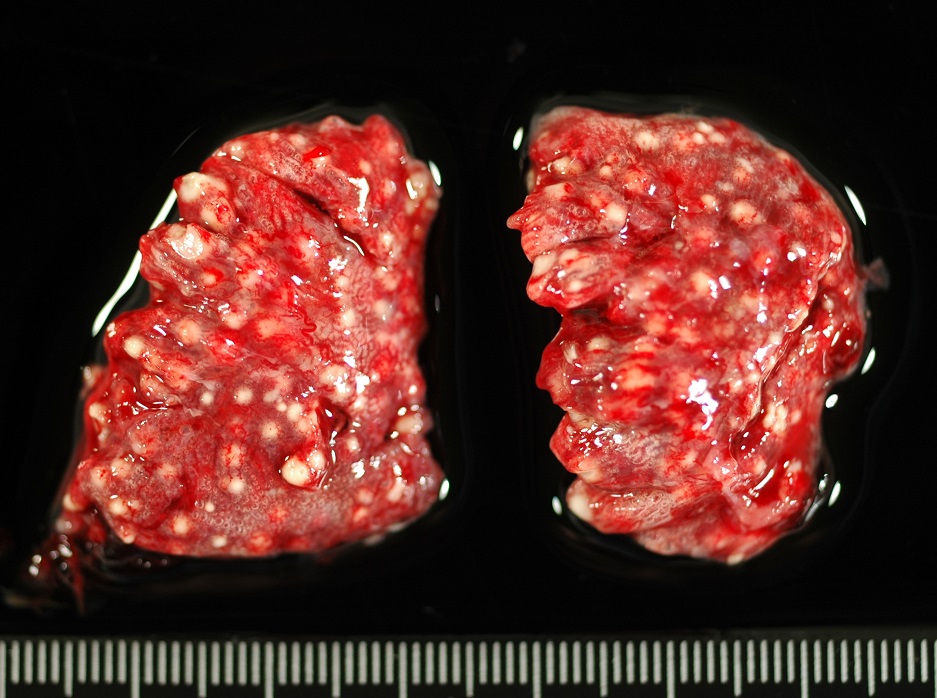
El uso de perros para la caza también fue un factor de riesgo significativo, siendo la caza también un factor de riesgo de blastomicosis en humanos. Tanto los humanos como los perros que cazan tienen presumiblemente más probabilidades de estar expuestos a conidios de este hongo. Los agentes etiológicos de la blastomicosis son hongos dimórficos que existen como forma miceliar en el medio ambiente y como levadura en los tejidos. La forma miceliar produce conidios que forman aerosoles cuando se remueve el suelo. Una vez inhalados, los conidios son fagocitados por los macrófagos alveolares y se transforman en levaduras. Las manifestaciones clínicas pulmonares se producen en más del 80% de los perros afectados, siendo las anomalías respiratorias el motivo más común de evaluación clínica en estos animales. También son frecuentes las afecciones del sistema linfático, las oculares, las osteoarticulares y las de la piel. Desgraciadamente, el diagnóstico se retrasa a menudo debido a la falta de conocimiento del clínico y a las similitudes que presentan los síntomas con los de otras enfermedades. Las tasas de mortalidad pueden acercarse al 40% en los perros, y se producen recaídas en hasta el 20% de los pacientes caninos, a pesar de estar meses con terapia antifúngica.
Desde hace tiempo, se conoce que el nicho ecológico de B. dermatitidis incluye zonas con suelos que presentan pH ácido, un alto contenido orgánico y próximos a vías fluviales. Este hongo es extremadamente difícil de aislar de muestras ambientales, por lo que se conoce poco sobre su reservorio ambiental. Por este motivo, la presencia y la localización de este patógeno se infiere de los datos epidemiológicos asociados a los brotes de la enfermedad. No obstante, en un estudio reciente realizado en Minnesota [Jackson et al. 2021] se utilizó un método independiente del cultivo y basado en la PCR para identificar DNA de B. dermatitidis en muestras ambientales, con el fin de caracterizar su nicho ambiental. Este estudio muestra lugares con alta prevalencia geográfica de esta especie en el medio ambiente. Combinando los datos moleculares con la modelización del nicho ecológico, estos autores pudieron predecir la presencia de B. dermatitidis en muestras ambientales con una precisión del 75% y definir las características del nicho ambiental de este hongo.
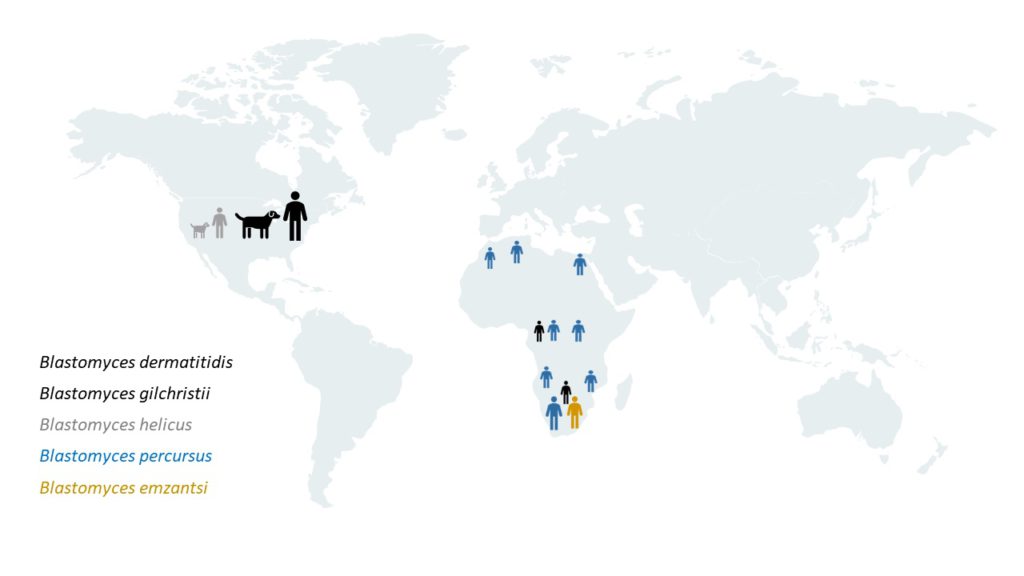
Sin embargo, recientemente se han descrito otras especies causantes de esta micosis, siendo su diversidad genética y geográfica mayor de lo que se apreciaba anteriormente. Además de B. dermatitidis y la especie críptica Blastomyces gilchristii, que causan la blastomicosis en el medio oeste y en varias zonas del este de Norteamérica, Blastomyces helicus produce ocasionalmente una blastomicosis atípica en algunas zonas del oeste. Además, esta micosis en humanos se da en toda África y Oriente Medio y está causada predominantemente por Blastomyces percursus y, al menos en Sudáfrica, por Blastomyces emzantsi, produciendo distintos patrones clínicos y patológicos de la enfermedad [Schwartz et al. 2021]. Este reciente, interesante y detallado estudio confirma que los patógenos que causan la blastomicosis en estos países son mayoritariamente distintos de los que causan la enfermedad en Norteamérica. Por otra parte, en esta publicación se describe la nueva especie B. emzantsi. Emzantsi significa sur en la lengua isiXhosa, en referencia a Sudáfrica, el país de origen de la especie tipo de este nuevo taxón. Además, este trabajo también incluye una exhaustiva búsqueda y revisión bibliográfica sobre casos de blastomicosis en humanos y en animales, diagnosticados o supuestamente adquiridos en África y Oriente Medio, en la que se identificaron siete publicaciones sobre blastomicosis en animales. En general, la información incluida en estas publicaciones veterinarias sobre el diagnóstico de la enfermedad y la identificación de las especies fúngicas implicadas es cuestionable, ya que en ellas se ofrecen pocos detalles y, en los pocos casos en los que se obtuvieron cultivos, no se llevó a cabo la confirmación molecular de la identificación de los aislados. Desafortunadamente, ninguna de las cepas analizadas en este estudio procedía de animales, por lo que se desconocen las especies implicadas en la blastomicosis animal en estos países. En la actualidad, no existen datos fiables sobre la presencia de blastomicosis y su etiología en los animales domésticos y salvajes de África y Oriente Medio.