



XV Congreso Nacional de Micología, 7-9 de septiembre de 2022
QUEDA CERRADA LA RECEPCIÓN DE COMUNICACIONES

Enfermedad Fúngica Invasora EFI-7 (7 septiembre 2022)


F. Javier Cabañes.
Grupo de Micología Veterinaria, Departamento de Sanidad y Anatomía Animales, Facultad de Veterinaria, Universitat Autònoma de Barcelona, Bellaterra, España.
Enero 2020.
Los dermatofitos siguen citándose entre las causas más frecuentes de problemas dermatológicos en los animales domésticos. No obstante, sólo un pequeño porcentaje de estas especies causan normalmente tiñas en los animales [Cabañes, 2000]. Tal como ya hemos comentado en este blog, los nombres de algunas de las especies que causan dermatofitosis han cambiado y actualmente se engloban en los géneros Lophophyton, Nannizzia, Microsporum y Trichophyton. Hay que destacar que los animales funcionan como reservorio de los denominados dermatofitos zoófilos y sus infecciones presentan una considerable importancia zoonótica, ya que se transmiten con cierta frecuencia al hombre. Por ejemplo, el gato es el principal reservorio de Microsporum canis, siendo esta especie la mayor responsable de las tiñas de los perros y de los gatos. En el caso de los gatos, el porcentaje de aislamiento suele ser superior al 90%. En ambas especies animales la dermatofitosis es una enfermedad frecuente en individuos jóvenes.

Tal como se indica en las últimas recomendaciones de consenso sobre el diagnóstico y el tratamiento de la dermatofitosis en gatos y perros [Moriello et al. 2017], aportadas en el ámbito de la Asociación Mundial de Dermatología Veterinaria, M. canis se encuentran entre los principales microorganismos, junto con Campylobacter spp., Salmonella spp., Toxoplasma gondii, que con frecuencia se consideran de mayor preocupación a ser transmitidos por estos animales a sus dueños y personal de alto riesgo en la clínica veterinaria.
No obstante, tal como se puntualiza en estas directrices, la dermatofitosis, a pesar de ser una conocida zoonosis que causa lesiones en la piel de los humanos, es tratable y curable. Sin embargo, estos autores resaltan que hay pocos estudios en los que se haya investigado con precisión qué proporción de tiñas que se producen en el hombre es atribuible a las mascotas. Las enfermedades asociadas a las mascotas pueden ocurrir en cualquier individuo, pero tienen mayor riesgo los niños menores de 5 años, los adultos mayores de 65, las embarazadas y las personas con algún tipo de inmunodeficiencia.

Esta enfermedad se transmite principalmente por contacto con el pelaje o las lesiones de la piel de un animal infectado. Las escamas y el pelo procedentes de estos animales se pueden acumular en el ambiente y son también posibles fuentes de infección. Esto se debe principalmente al gran número de artroconidios que se forman en el pelo de los animales con dermatofitosis, que presentan generalmente diámetros inferiores a los 5 micrómetros y que son los causantes de la infección. No obstante, es difícil determinar la verdadera prevalencia de esta enfermedad, ya que no es de declaración obligatoria. Si bien en estas recomendaciones ninguna de las pruebas diagnósticas utilizadas habitualmente fue escogida como la de elección, se destaca que lo importante es saber que técnicas nos permiten confirmar la presencia o ausencia de una infección activa en el animal. En el laboratorio, el diagnóstico se realiza de forma tradicional por medio de la observación directa de los pelos con sospecha de dermatofitosis, prueba de total especificidad pero que presenta una moderada sensibilidad. Se confirma mediante el cultivo de los pelos en medios apropiados, prueba que presenta mayor sensibilidad y permite además la identificación de la especie implicada. El cultivo también permite detectar la presencia de portadores mecánicos transitorios y los infectados sin lesiones aparentes, y monitorizar infecciones. Las técnicas de PCR pueden ser de utilidad, aunque hay que recordar que pueden dar resultados falsos positivos en casos de infecciones no activas, al detectar DNA de elementos fúngicos no viables. Con respecto al éxito del tratamiento en perros y gatos, en estas directrices se recomienda el uso simultáneo de antifúngicos sistémicos orales, como el itraconazol o la terbinafina, y la desinfección tópica del pelo de estos animales.
F. Javier Cabañes.
Grupo de Micología Veterinaria, Departamento de Sanidad y Anatomía Animales, Facultad de Veterinaria, Universitat Autònoma de Barcelona, Bellaterra, España.
Noviembre 2019.
La criptococosis es una micosis esporádica y poco frecuente que afecta a una gran variedad de animales en todo el mundo. Está causada por unas levaduras pertenecientes a los basidiomicetos que se agrupan en los complejos de especies de Cryptococcus neoformans y Cryptococcus gattii, cuya especiación se mantiene controvertida desde hace muchos años. En la última revisión taxonómica, basada principalmente en el análisis filogenético de estos complejos, se ha propuesto dividir C. neoformans en dos especies y C. gattii en cinco, describiéndose también la presencia de distintos híbridos [Hagen et al. 2015].
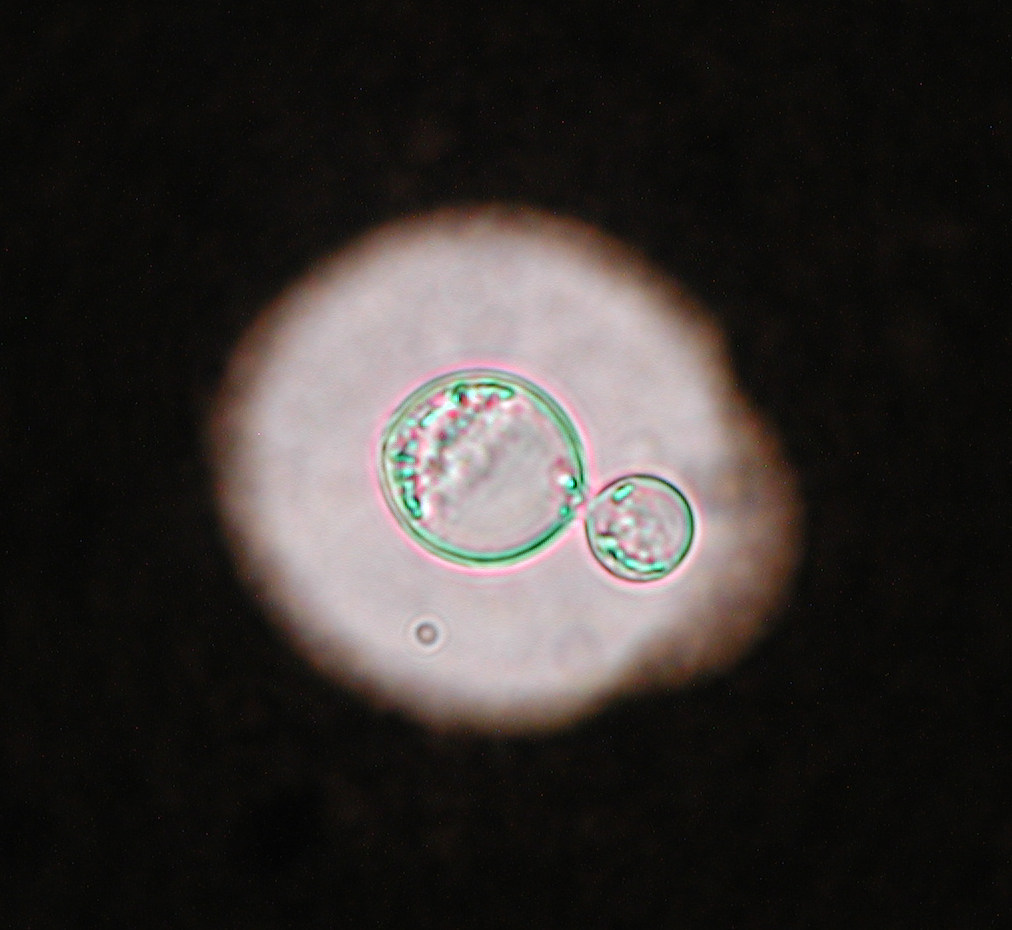
En los animales domésticos la infección se origina en la cavidad nasal, tras la inhalación de la levadura. En el gato y en el perro, suele diseminarse al sistema respiratorio y al sistema nervioso central, detectándose también formas cutáneas en casos avanzados. A pesar de ser poco frecuente, la criptococosis es la micosis sistémica más común en los gatos. El tratamiento suele combinar la resección quirúrgica de los granulomas y el tratamiento con antifúngicos. En caballos, ovejas y cabras suele afectar al sistema respiratorio, mientras que en las vacas suele ser una micosis localizada a nivel de la glándula mamaria [Castellá et al. 2008]. El examen citológico de los aspirados obtenidos de ganglios, nódulos o de líquido cefalorraquídeo, entre otras muestras, permite visualizar la presencia de la cápsula característica en estas levaduras. Aunque estas levaduras crecen bien en los medios de cultivo utilizados en clínica, su identificación a nivel de especie es compleja, necesitando la utilización de diversas técnicas (p.e. AFLP, MLST, RFLP) para definir los distintos tipos moleculares.
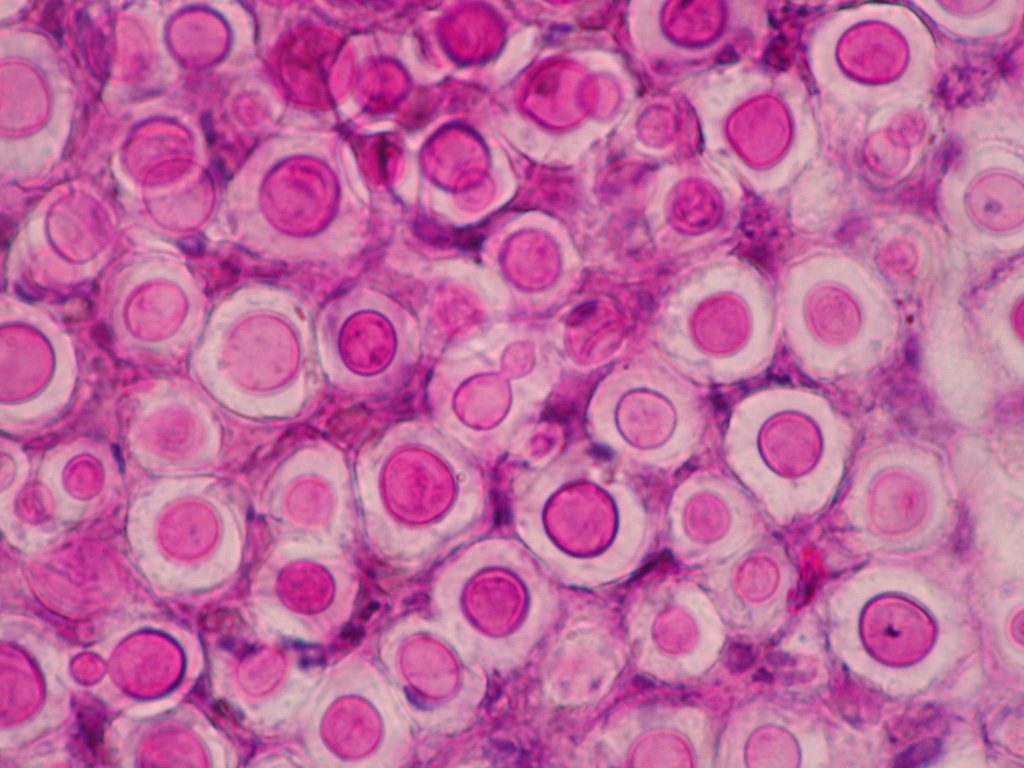
En perros y gatos, la especie más frecuentemente aislada es C. neoformans, que incluye los tipos moleculares VNI-VNII/AFLP1. La nueva especie C. deneoformans (VNIV/AFLP2) se aísla en menor proporción. Un importante reservorio ambiental de ambas especies son los excrementos de paloma y de otras aves. Hasta finales del siglo XX, la mayoría de los casos en perros y gatos se relacionaban con infecciones producidas por el complejo C. neoformans. Este complejo presenta distribución ubicua y se considera un patógeno oportunista que causa enfermedad principalmente en pacientes inmunodeprimidos. De hecho, era raro encontrar en la bibliografía casos producidos por cepas del complejo C. gattii, con la excepción de los descritos en Australia donde está ampliamente distribuido. En este caso se trata de un patógeno primario considerado endémico de regiones tropicales y subtropicales, presente en la naturaleza en suelos y numerosas especies de árboles. No obstante en las dos últimas décadas han ido apareciendo casos en distintas especies animales producidas por cepas del complejo C. gattii en zonas templadas de otros continentes, como el europeo o el americano. Existen diferentes hipótesis que podrían explicar este cambio en la etiología de la criptococosis como la importación de eucaliptos de Australia, el calentamiento global, las corrientes oceánicas y eólicas, el movimiento de animales y de manera sorpresiva los tsunamis [Engelthaler y Casadevall, 2019].
En este último caso, podría ser que un tsunami acontecido a mediados del siglo pasado, que afectó determinadas zonas de la costa noroeste de Canadá y EEUU, fuese el causante de la introducción de algunas cepas del complejo C. gattii típicos de zonas más cálidas. Estas cepas habrían llegado mediante transporte marítimo desde Sudamérica, posiblemente en el agua de lastre de los buques.
Aunque desconocemos la distribución global de las nuevas especies, C. gattii (VGI/AFLP4), C. deuterogattii (VGII/AFLP6) y C. bacillosporus (VGIII/AFLP5) se aíslan con menor frecuencia de casos de criptococosis en perros y gatos. No obstante, C. deuterogattii es la principal responsable del brote de criptococosis humana aparecido en 1999 en la Isla de Vancouver (British Columbia, Canadá), que también afectó a perros y gatos. Esta especie también se ha detectado en distintos estados de la región del Noroeste del Pacífico de EEUU. Asimismo, parece ser que C. bacillosporus se aísla frecuentemente en casos de criptococosis felina en California (EEUU), pero no en perros. Por último, C. tetragattii (VGIV/ AFLP7) y C. decagattii (AFLP10) son especies raras y se desconoce por el momento su presencia en estos animales.
Octubre 2019.
Grupo de Micología Veterinaria, Departamento de Sanidad y Anatomía Animales, Facultad de Veterinaria, Universitat Autònoma de Barcelona, Bellaterra, España.
Los caballos presentan unas estructuras anatómicas que contienen aire, situadas en el lado dorsal de la cavidad faríngea denominadas bolsas guturales. Las paredes de estas bolsas están en contacto con nervios y vasos importantes que riegan el cerebro. Por este motivo, el desarrollo de ciertas especies fúngicas en las mucosas de estas bolsas puede ser la causa de una micosis especialmente grave. El crecimiento del hongo erosiona las arterias carótidas, produciéndose hemorragias importantes que causan la muerte fulminante del animal.
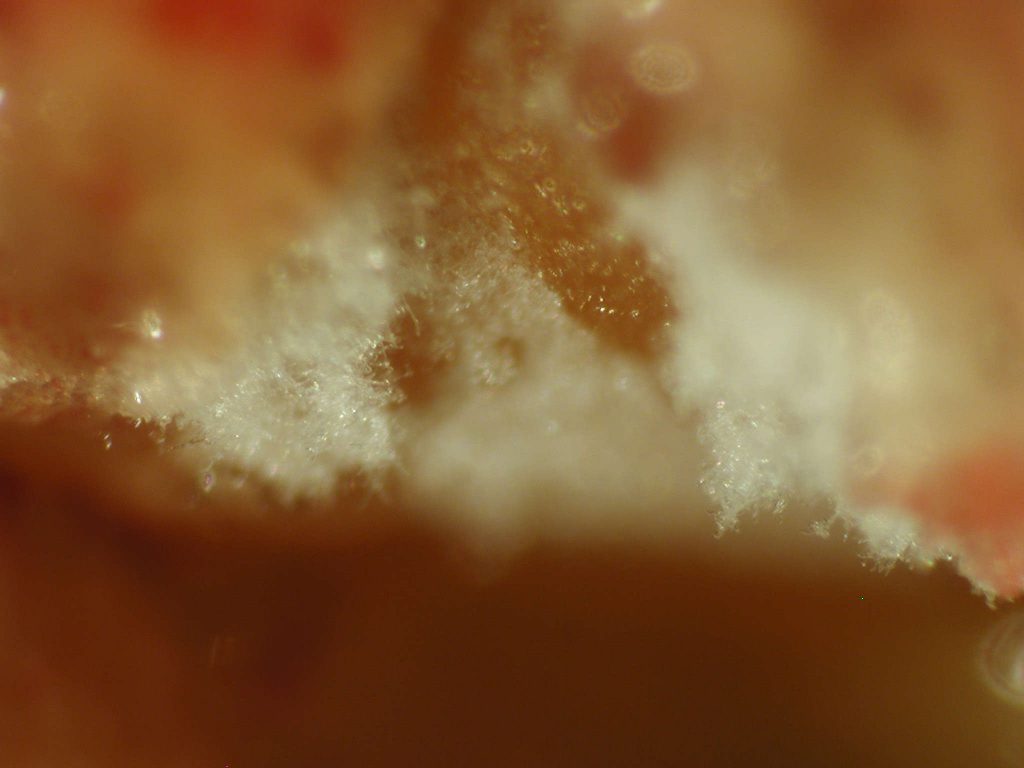
Uno de los signos iniciales más frecuentes en estos casos es la presencia de hemorragia nasal. También se suele detectar disfagia, debido a la afectación de diversos nervios anejos que controlan la deglución, y determinadas afecciones neurológicas. El tratamiento de elección suele ser quirúrgico, mientras que la terapia con antifúngicos presenta una eficacia cuestionable [Lepage et al. 2004]. Parece ser que esta micosis es más común de lo que se piensa, aunque raramente se identifica la especie fúngica participante. De las especies implicadas destaca, de forma extraordinaria, Aspergillus nidulans por su alta frecuencia de aislamiento, en comparación con el bajo porcentaje que presenta en general esta especie en otras micosis. Sus cultivos se caracterizan por presentar ascosporas rojizas, lenticulares, de paredes lisas con dos crestas ecuatoriales, formadas en cleistotecios marrón rojizos rodeados de numerosas células de Hülle, lo que la diferencian fácilmente de la mayoría de especies de este género [Cabañes et al. 2002]. Las colonias suelen presentar diversas coloraciones según los medios de cultivo utilizados, creciendo perfectamente a 45ºC.
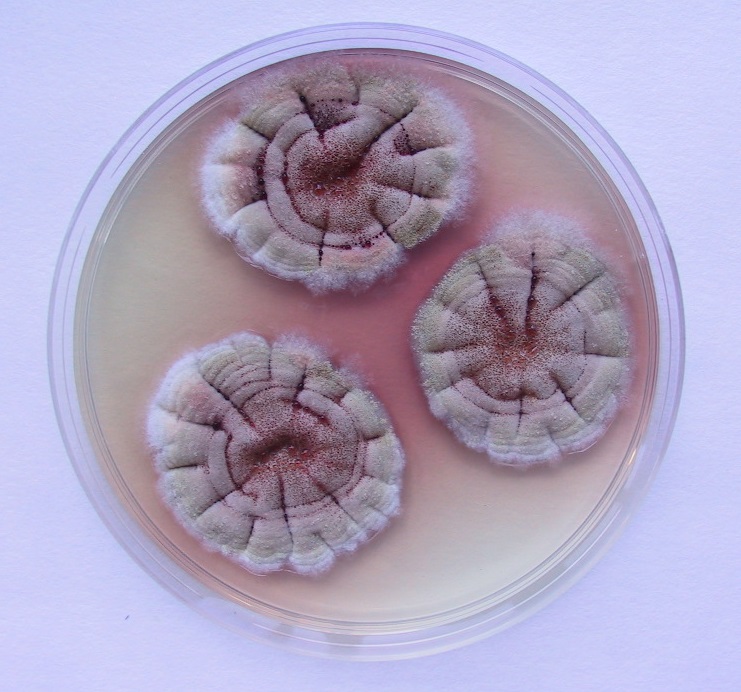
También es extraordinario el porcentaje de aspergilosis invasora causada por A. nidulans en pacientes humanos con enfermedad granulomatosa crónica, una inmunodeficiencia primaria rara que afecta principalmente a la función de los fagocitos, que puede llegar a ser del 33%. De forma general, las aspergilosis invasoras tienen lugar en pacientes con neoplasias hematológicas e inmunodeficiencias importantes y están causadas comúnmente por Aspergillus fumigatus, siendo A. nidulans responsable de tan sólo el 1% de los casos. Investigaciones recientes [Gresnigt et al. 2018] demuestran que los conidios de esta especie son fagocitados y procesados por los macrófagos a un ritmo más lento en comparación con los de A. fumigatus, por lo que se reduce la tasa de mortalidad fúngica y aumenta la germinación de los conidios. Esta tasa más lenta de eliminación de A. nidulans podría permitir un crecimiento excesivo de esta especie en ciertos ambientes inmunes.
Desconocemos si esta diferencia de respuesta inmune innata se produce en las bolsas guturales. No obstante, la diferente actividad fagocitaria demostrada frente a estas dos especies fúngicas podría facilitar la colonización de A. nidulans en este entorno y por lo tanto también podría ser la responsable del elevado porcentaje de casos producidos de micosis de las bolsas guturales por esta especie.