F. Javier Cabañes.
Grupo de Micología Veterinaria, Departamento de Sanidad y Anatomía Animales, Facultad de Veterinaria, Universitat Autònoma de Barcelona, Bellaterra, España.
Enero 2020.
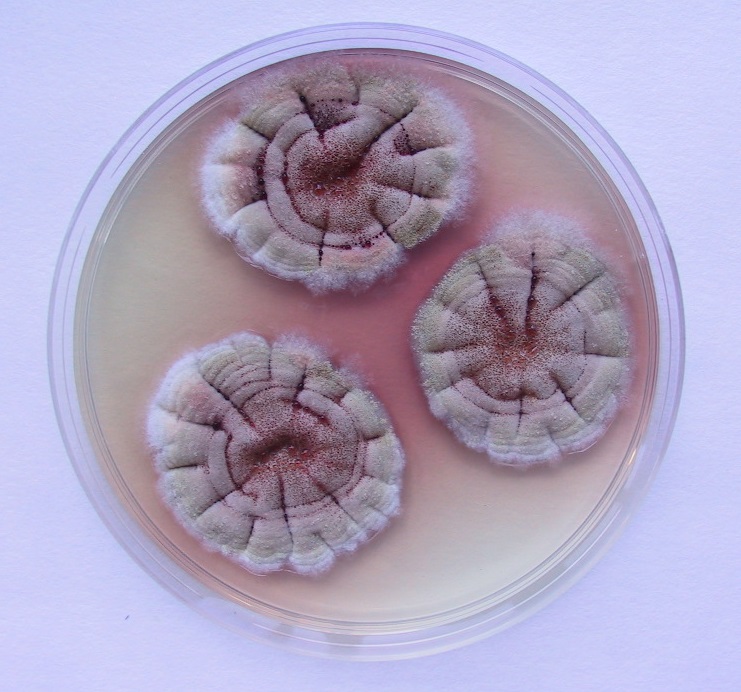
Los dermatofitos siguen citándose entre las causas más frecuentes de problemas dermatológicos en los animales domésticos. No obstante, sólo un pequeño porcentaje de estas especies causan normalmente tiñas en los animales [Cabañes, 2000]. Tal como ya hemos comentado en este blog, los nombres de algunas de las especies que causan dermatofitosis han cambiado y actualmente se engloban en los géneros Lophophyton, Nannizzia, Microsporum y Trichophyton. Hay que destacar que los animales funcionan como reservorio de los denominados dermatofitos zoófilos y sus infecciones presentan una considerable importancia zoonótica, ya que se transmiten con cierta frecuencia al hombre. Por ejemplo, el gato es el principal reservorio de Microsporum canis, siendo esta especie la mayor responsable de las tiñas de los perros y de los gatos. En el caso de los gatos, el porcentaje de aislamiento suele ser superior al 90%. En ambas especies animales la dermatofitosis es una enfermedad frecuente en individuos jóvenes.

Tal como se indica en las últimas recomendaciones de consenso sobre el diagnóstico y el tratamiento de la dermatofitosis en gatos y perros [Moriello et al. 2017], aportadas en el ámbito de la Asociación Mundial de Dermatología Veterinaria, M. canis se encuentran entre los principales microorganismos, junto con Campylobacter spp., Salmonella spp., Toxoplasma gondii, que con frecuencia se consideran de mayor preocupación a ser transmitidos por estos animales a sus dueños y personal de alto riesgo en la clínica veterinaria.
No obstante, tal como se puntualiza en estas directrices, la dermatofitosis, a pesar de ser una conocida zoonosis que causa lesiones en la piel de los humanos, es tratable y curable. Sin embargo, estos autores resaltan que hay pocos estudios en los que se haya investigado con precisión qué proporción de tiñas que se producen en el hombre es atribuible a las mascotas. Las enfermedades asociadas a las mascotas pueden ocurrir en cualquier individuo, pero tienen mayor riesgo los niños menores de 5 años, los adultos mayores de 65, las embarazadas y las personas con algún tipo de inmunodeficiencia.

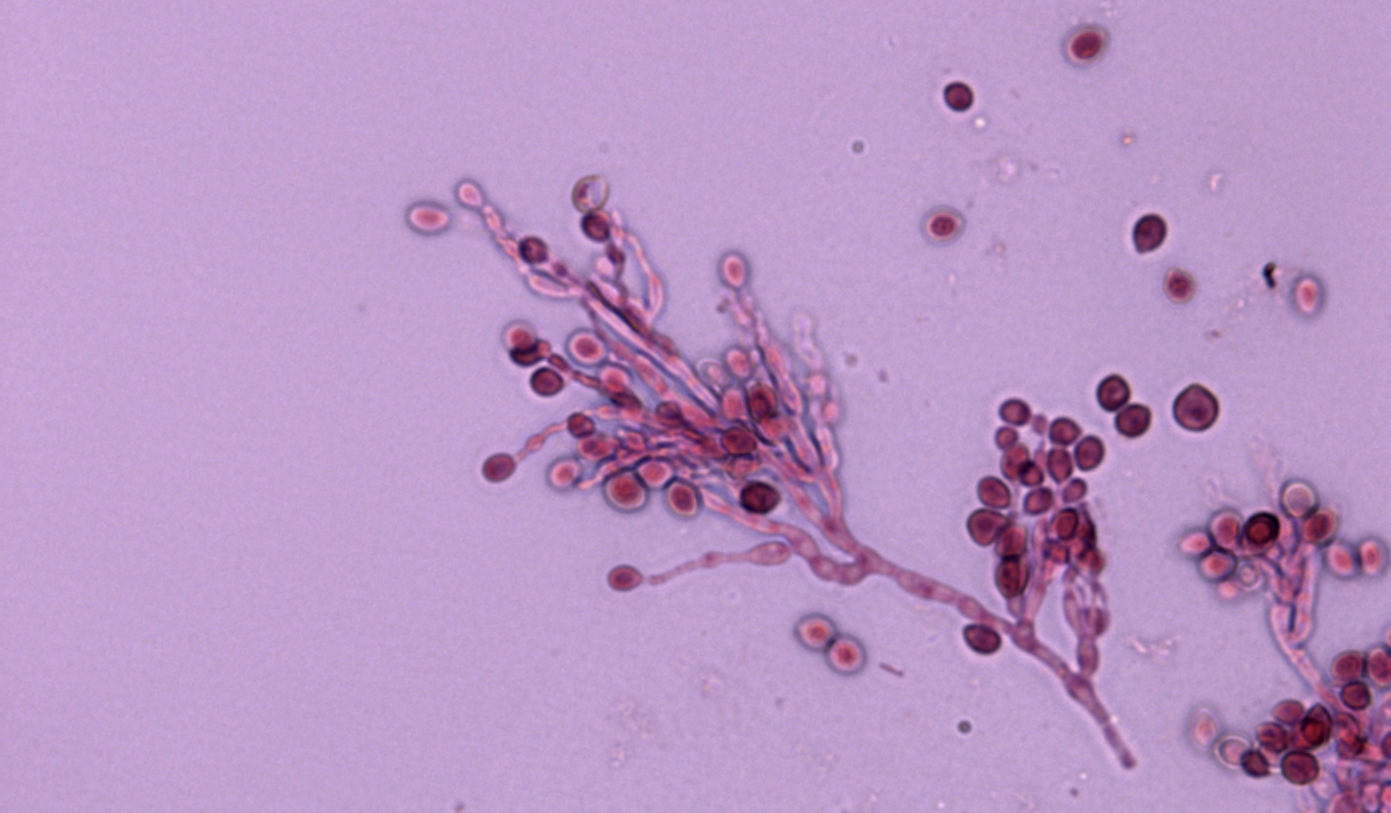
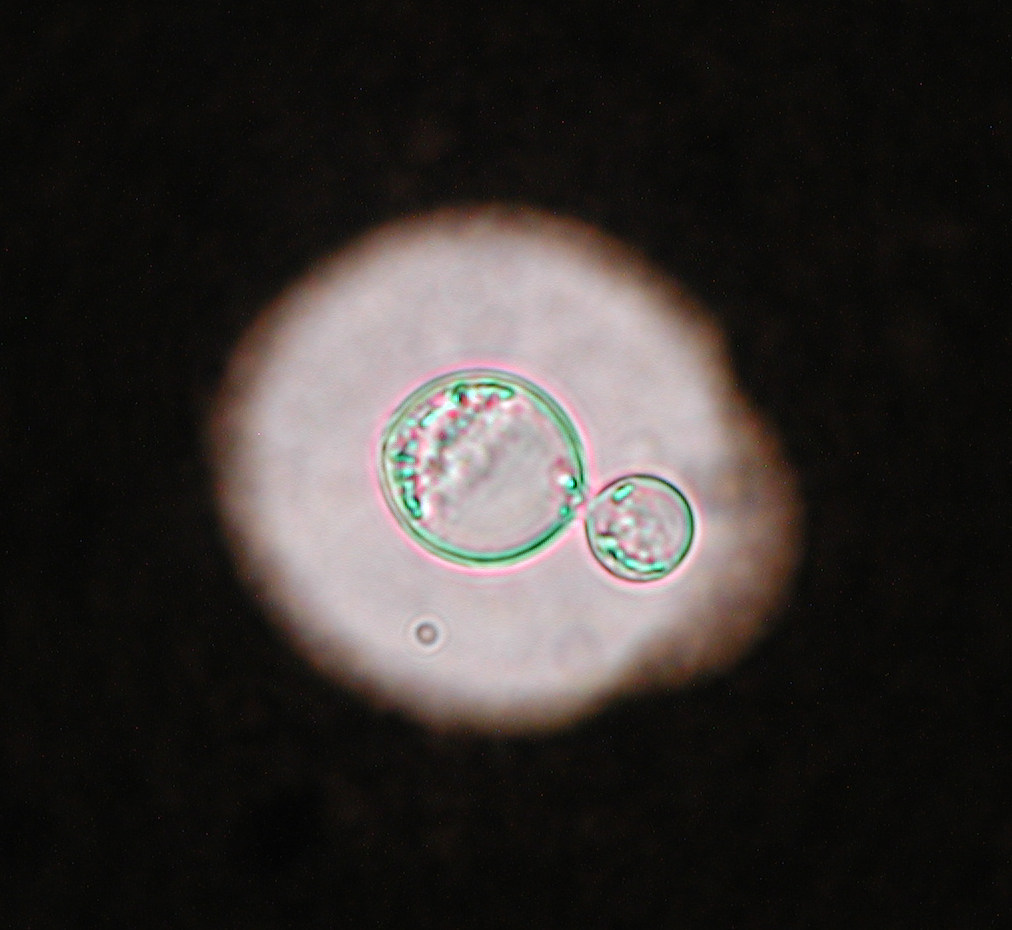
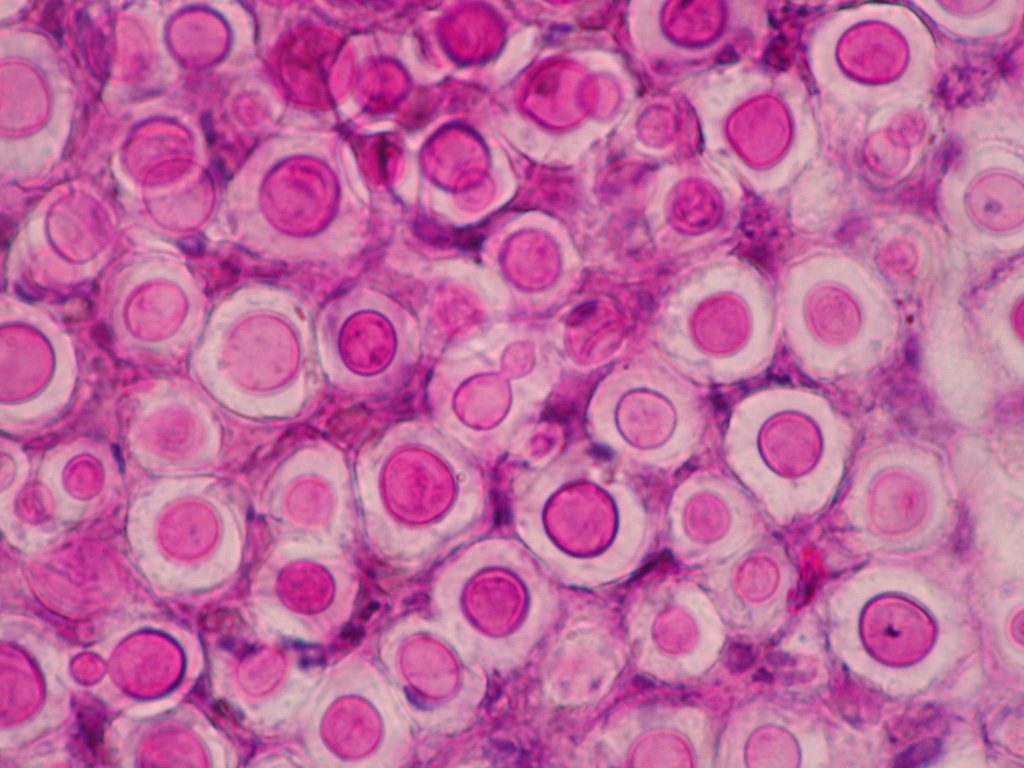
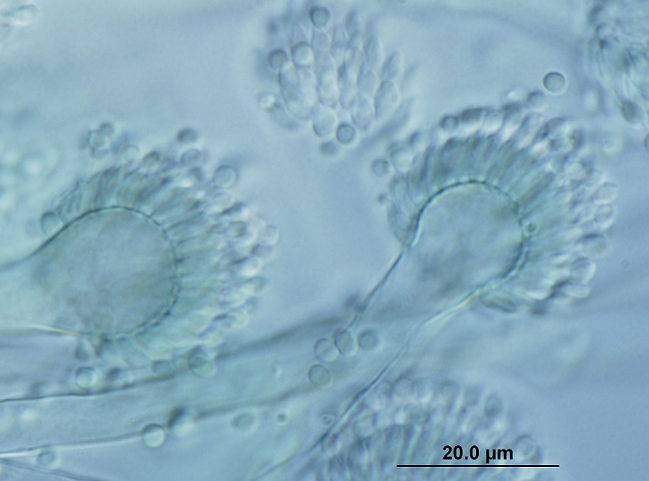
Esta enfermedad se transmite principalmente por contacto con el pelaje o las lesiones de la piel de un animal infectado. Las escamas y el pelo procedentes de estos animales se pueden acumular en el ambiente y son también posibles fuentes de infección. Esto se debe principalmente al gran número de artroconidios que se forman en el pelo de los animales con dermatofitosis, que presentan generalmente diámetros inferiores a los 5 micrómetros y que son los causantes de la infección. No obstante, es difícil determinar la verdadera prevalencia de esta enfermedad, ya que no es de declaración obligatoria. Si bien en estas recomendaciones ninguna de las pruebas diagnósticas utilizadas habitualmente fue escogida como la de elección, se destaca que lo importante es saber que técnicas nos permiten confirmar la presencia o ausencia de una infección activa en el animal. En el laboratorio, el diagnóstico se realiza de forma tradicional por medio de la observación directa de los pelos con sospecha de dermatofitosis, prueba de total especificidad pero que presenta una moderada sensibilidad. Se confirma mediante el cultivo de los pelos en medios apropiados, prueba que presenta mayor sensibilidad y permite además la identificación de la especie implicada. El cultivo también permite detectar la presencia de portadores mecánicos transitorios y los infectados sin lesiones aparentes, y monitorizar infecciones. Las técnicas de PCR pueden ser de utilidad, aunque hay que recordar que pueden dar resultados falsos positivos en casos de infecciones no activas, al detectar DNA de elementos fúngicos no viables. Con respecto al éxito del tratamiento en perros y gatos, en estas directrices se recomienda el uso simultáneo de antifúngicos sistémicos orales, como el itraconazol o la terbinafina, y la desinfección tópica del pelo de estos animales.